Prácticamente todo el mundo ha experimentado, incluso sin saberlo, lo qué es el equilibrio térmico. Por ejemplo, la cerveza fría sobre la mesa debe consumirse antes de que se caliente. La comida que sacas del microondas esta demasiado caliente para comerla, por lo que debes esperar a que se enfríe.
Estos son solo algunas situaciones en las que el equilibrio termal esta presente en nuestras vidas. Sin embargo, ¿conoces realmente la definición de equilibrio térmico? Quizás tampoco sepas la relación que existe entre el balance térmico y la Ley cero de la termodinámica.
Pero descuida, aquí en Buscador daremos respuestas a todas estas interrogantes, e incluso te compartiremos algunos ejemplos de equilibrio termal.
¿Qué es el equilibrio térmico?
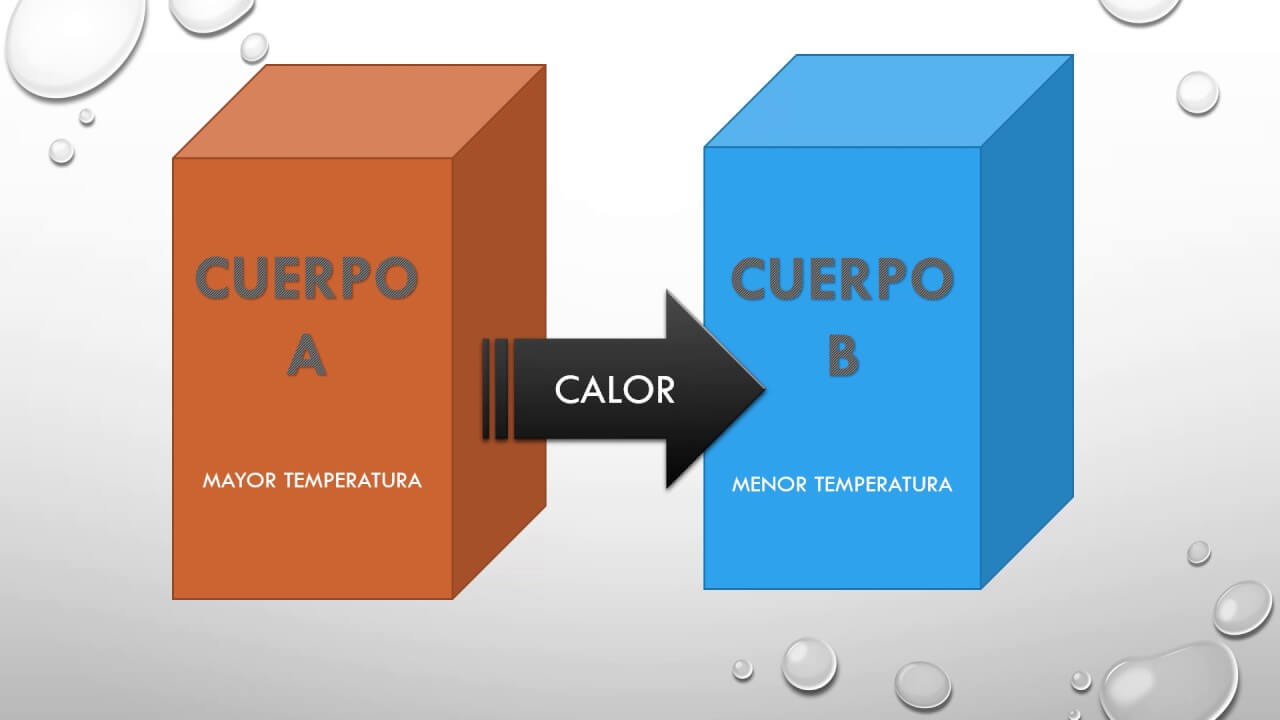
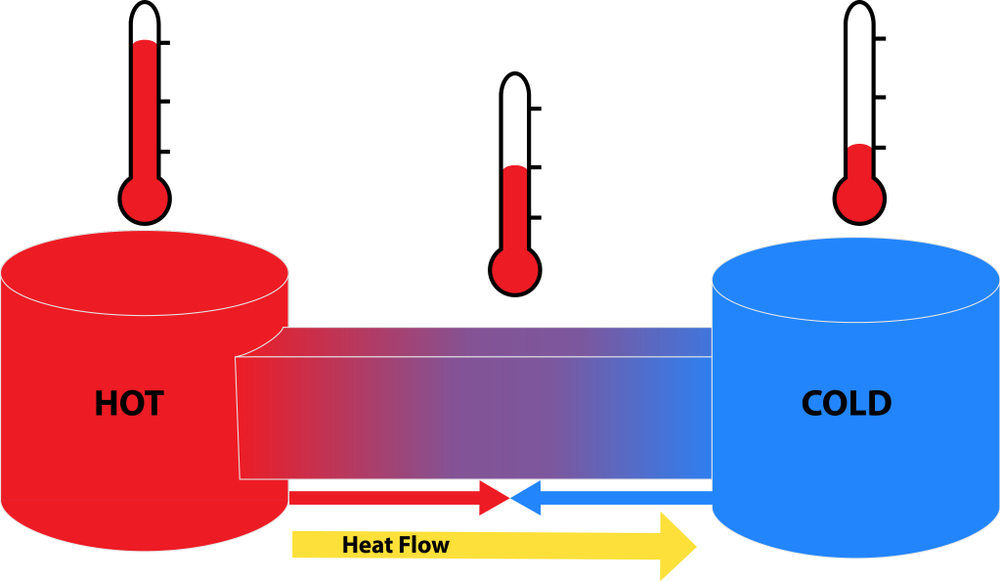
Lo que sucede con el equilibrio termal es que cuando dos cuerpos con diferentes temperaturas, entran en contacto, el cuerpo más caliente cede parte de su energía al cuerpo que tiene la temperatura más baja. Esto sucede hasta el punto en que ambos cuerpos tienen la misma temperatura.
En base a lo anterior, la definición de equilibrio térmico se establece de la siguiente manera:
Equilibrio térmico es un estado en el que todas las partes de un sistema se encuentran a la misma temperatura.
Básicamente es un estado en el que se igualan las temperaturas de dos cuerpos que inicialmente tenían temperaturas diferentes. Sucede que cuando se igualan las temperaturas de ambos cuerpos, se suspende el flujo de calor. Después de esto se alcanza el estado de equilibrio termal.
En teoría, el balance térmico es fundamentalmente lo que se conoce como la Ley Cero de la termodinámica, que veremos más adelante. En esencia, el equilibrio termal implica tres características: El estado estacionario, la ergodicidad, y la distribución térmica.
El estado estacionario sencillamente significa que el balance térmico de un estado es dinámicamente establece. En consecuencia, este sistema permanecerá sin modificaciones a menos que algo adicional suceda.
Por su parte, la ergodicidad significa que cualquier cuerpo de un sistema que se encuentra térmicamente equilibrado, se encuentra en equilibrio térmico. En cuanto a la distribución térmica, es la distribución de probabilidad que todos los cuerpos del sistema deben seguir.
Diferencias entre calor y temperatura
Al hablar del balance térmico innegablemente hay dos factores involucrados de gran importancia: el calor y la temperatura. La diferencia básica entre el calor y la temperatura, es que el calor es la forma de energía que se transfiere de un cuerpo caliente, a un cuerpo frío. La unidad calorífica es el Joule.
Por su parte, la temperatura es el grado de calor y frialdad de un cuerpo, siendo su unidad el Kelvin. Otras diferencias entre el calor y la temperatura son las siguientes:
Calor
- Es la energía cinética total y potencial obtenida por las moléculas de un objeto.
- Además, el calor fluye del cuerpo al cuerpo frío.
- No solo eso, el calor también tiene capacidad de trabajo.
- El calor se mide con el calorímetro y su símbolo es “Q”.
Temperatura
- La temperatura se incrementa cuando se calienta, y disminuye cuando se enfría un objeto.
- No tiene capacidad de trabajo.
- Para medir la temperatura se utiliza los termómetros.
- Su unidad de medición es el “Kelvin” y su símbolo es la “T”.
Equilibrio térmico de la cantidad de calor
La ecuación que permite cuantificar la cantidad de calor que se intercambia en las transferencias entre los cuerpos, es la siguiente:
Q = M * C * ΔT
En dicha ecuación Q representa la cantidad de calor expresada en calorías, mientras que la M representa la masa del cuerpo en estudio. Por su parte, la letra C representa el calor específico del cuerpo, y el símbolo ΔT es la diferencia de temperatura.
En una situación de equilibrio termal, la masa y el calor específico retienen su valor original, sin embargo la diferencia de temperatura se vuelve 0. Esto se debe a que el estado de equilibrio donde no hay cambios de temperatura fue definido con precisión.
Equilibrio térmico de temperatura
Otra ecuación importante para entender el significado de equilibrio térmico es la que busca expresar la temperatura que tendrá el sistema unificado. Se concluye que cuando un sistema de partículas N1, que se encuentra a una temperatura T1, entra en contacto con otro sistema de partículas N2, que se encuentra a la temperatura T2, la temperatura de equilibrio se obtiene a través de la siguiente fórmula:
(N1 * T1 + N2 * T2 ) / (N1 + N2)
De esta manera, se puede observar que cuando ambos subsistemas tienen la misma cantidad de partículas, la temperatura de equilibrio se reduce a una temperatura media entre las dos temperaturas iniciales. Lo anterior es algo que se puede generalizar para las relaciones entre más de dos subsistemas.
¿Qué es la Ley Cero de la Termodinámica?
La ley cero de la termodinámica, también conocida como Principio Cero de la Termodinámica, establece que si dos cuerpos están cada uno en equilibrio térmico con algún tercer cuerpo, entonces también están en equilibrio termal entre sí. El balance térmico significa que cuando dos cuerpos se ponen en contacto entre sí y se separan por una barrera que es permeable al calor, no habrá transferencia de calor de un cuerpo a otro.
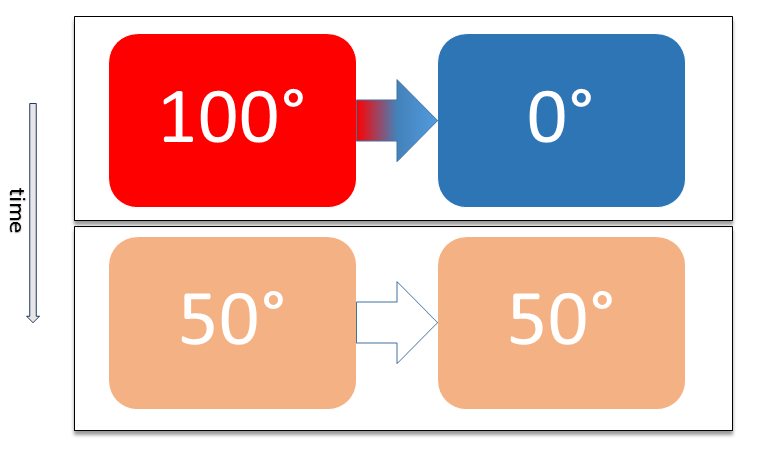
Lo anterior supone que los tres cuerpos tienen la misma temperatura. James Clerk Maxwell expresó este principio de una forma más simplificada al indicar que: “Todo el calor es del mismo tipo“. Lo más importante es entender que la Ley Cero establece que la temperatura es una propiedad de la materia fundamental y medible.
Historia de la termodinámica
Inicialmente, cuando se establecieron las leyes de la termodinámica, solo existían tres leyes. Sin embargo, a principios del siglo XVIII, los científicos se dieron cuenta de que era necesaria otra ley para completar el conjunto. No obstante, esta nueva ley, que presentó una definición formal de temperatura, en realidad reemplazó a las tres leyes de la termodinámica existentes, por lo que debería estar a la cabeza de la lista.
Lo anterior creó un dilema, puesto que las tres leyes originales ya eran bien conocidas por sus números asignados. En consecuencia, volver a numerarlas crearía una confusión con la literatura existente.
Originalmente se pensó en llamar a esta nueva ley la Cuarta Ley y ponerla en último lugar en la lista. Pero esto también representaba un problema ya que reemplazaba a las otras tres leyes. Fue entonces que al científico, Ralph H. Fowler, se le ocurrió una solución que básicamente resolvió el dilema.
Se decidió llamar a la nueva ley la “Ley Cero de la Termodinámica“. En la actualidad, la Ley Cero o el Principio cero de la termodinámica nos dice que no importa cuánta energía tengan dos sistemas. Es decir, conocer cuánta energía tienen no nos permite predecir en qué dirección fluirá el calor, como si lo hace poner los dos sistemas en contacto entre sí.
La Ley Cero dice que esta cantidad, que es la temperatura, establece la dirección del flujo de calor, por lo que en realidad no depende directamente de la cantidad de energía que se encuentra involucrada.
Ejemplos de equilibrio térmico
A continuación, se muestran algunos ejemplos de situaciones en las que se produce el equilibrio térmico:

Ejemplo 1:
- Los productos que se venden con la etiqueta de “naturales”, pueden haber pasado por un refrigerador. Sin embargo, después de un tiempo fuera del frigorífico, y en contacto con el medio natural, los productos alcanzaron un equilibrio térmico con él entorno ambiental.
Ejemplo 2:
- La medición de la temperatura corporal mediante el uso de un termómetro funciona como balance térmico. Es decir, el largo período de tiempo que debe estar el termómetro en contacto con el cuerpo para poder cuantificar verdaderamente los grados de temperatura, se debe precisamente al tiempo que tarda en alcanzar el equilibrio termal.
Ejemplo 3:
- Otro ejemplo de equilibrio térmico es la permanencia de los glaciares en los mares y en los polos. De hecho, las advertencias sobre el calentamiento global tienen mucho que ver con un incremento de la temperatura de los mares, así como con un equilibrio térmico donde gran parte de ese hielo se derrite.
Ejemplo 4:
- Muchas sustancias como la mantequilla, son muy sensibles a los cambios de temperatura. Incluso al permanecer muy poco tiempo en contacto con el medio ambiente a temperatura natural, alcanzan el balance térmico y se derriten.
Ejemplo 5:
- Si colocas un cubo de hielo en un vaso de agua, también se produce un equilibrio termal. La única diferencia es que el equilibrio implica un cambio de estado, donde el agua pasa de estado sólido a estado líquido.
Ejemplo 6:
- Si colocas 1 litro de helado a temperatura ambiente, se derretirá más lentamente, en comparación ¼ de litro del mismo helado. Esto se debe a la ecuación en la que la masa determina las características del equilibrio térmico.
Otros ejemplos de equilibrio térmico
- Por ejemplo, si agregas agua fría a un recipiente con agua caliente, el equilibrio se alcanza muy rápidamente a una temperatura más fría que la inicial.
- Incluso, si pones tu mano sobre una barandilla fría por un tiempo, tu mano se volverá más fría.
- También puedes experimentar el equilibrio térmico cuando necesitas enfriar una taza de café, agregando leche fría.
Video sobre Equilibrio térmico:
Fuentes:
BBC – Thermal equilibrium – Energy stores and transfers
https://www.bbc.co.uk/bitesize/guides/z99jq6f/revision/6
Petropedia – Thermal equilibrium
https://www.petropedia.com/definition/9418/thermal-equilibrium
BYJU’S – Zeroth Law Of Thermodynamics
https://byjus.com/jee/zeroth-law-of-thermodynamics/
Wikilectures – Thermodynamic equilibrium