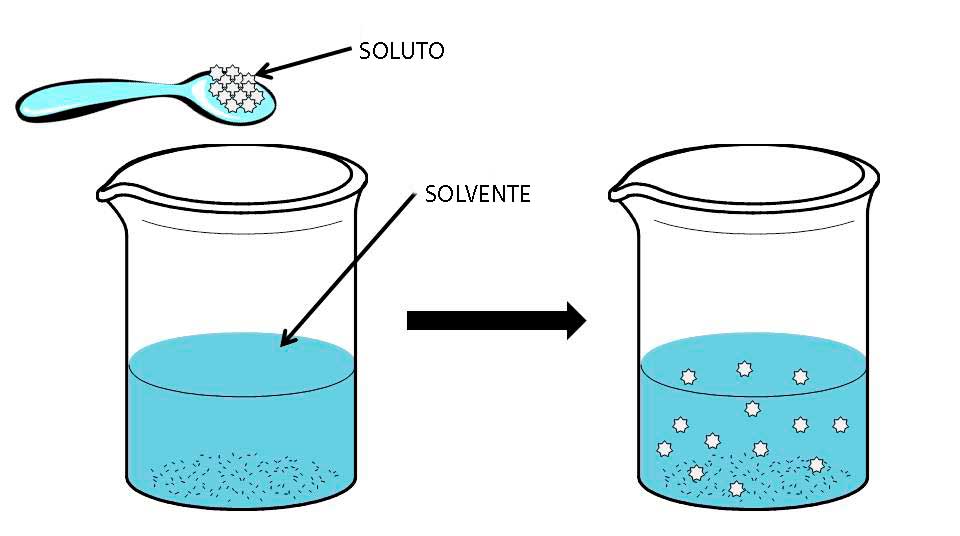
En química, disolver es hacer que un soluto se convierta en una solución. A este proceso también se le conoce como disolución. Normalmente, las disoluciones implican que un sólido pase a una fase líquida, sin embargo también puede involucrar otras transformaciones.
Es decir, cuando se forman aleaciones, un sólido se puede disolver en otro para formar una solución sólida. A continuación te hablamos sobre lo que significan las disoluciones, y los diferentes tipos que existen. También conocerás lo que es solubilidad y te mostraremos algunos ejemplos de disoluciones.
¿Qué son las disoluciones?
Una disolución a menudo se considera como una mezcla entre dos o más sustancias en proporciones variables, las cuales no reaccionan entre sí. Sin embargo, la definición más precisa es la siguiente:
Las disoluciones son mezclas homogéneas que se forman a partir de un disolvente y uno o múltiples solutos.
Cabe mencionar que se deben cumplir determinados criterios para que un proceso se considere disolución. Es decir, para líquidos y gases, la sustancia que se disuelve debe ser capaz de formar interacciones no covalentes con el solvente. En el caso de los sólidos, la estructura cristalina debe romperse para liberar átomos, iones o moléculas. Entonces cuando los compuestos iónicos se disuelven, se separan en los iones que los componen en el disolvente.

Por otra parte, el término solubilidad, del que hablaremos a detalle más adelante, se refiere a la facilidad con la que una sustancia se disuelve en un disolvente específico. Si se favorece la disolución, se dice que dicha sustancia es soluble en ese disolvente.
Por el contrario, si se disuelve muy poco soluto, se dice que es insoluble. Aquí es importante tener en cuenta que un compuesto o molécula puede ser soluble en un disolvente, pero insoluble en otro. Por ejemplo, el cloruro de sodio es soluble en agua, sin embargo no es tan soluble en disolventes orgánicos como trementina o la acetona.
Tipos de disoluciones
A continuación detallamos los tipos de disoluciones más comunes que se pueden crear a partir ciertas condiciones.

Disoluciones sólidas
- Sólido en sólido. Este tipo de disoluciones ocurren cuando tanto el soluto como el solvente se encuentran en estado sólido. Las aleaciones son un claro ejemplo de disoluciones sólidas, como es el caso del zinc en el estaño.
- Gas en sólido. En este tipo de disoluciones, un gas como el hidrógeno, se disuelve muy bien en metales, particularmente en el paladio, que es un sólido. De hecho, esta propiedad del paladio se aprovecha como una manera de almacenar hidrógeno.
- Líquido en sólido. Sucede cuando una sustancia en estado líquido, se mezcla con un sólido. Un ejemplo de ello serían las amalgamas, las cuales se forman a partir de un líquido como el mercurio que se usa en termómetros, disuelto en un metal sólido como la plata.
Disoluciones líquidas
- Sólido en líquido. Es una disolución que se utiliza con mucha frecuencia ya que se disuelven, generalmente, una pequeña cantidad de sustancia sólida en una enorme cantidad de sustancias líquidas. Un ejemplo común de este tipo de disolución es la que se forma al mezclar agua con azúcar.
- Gas en líquido. Ejemplos comunes de este tipo de disoluciones incluyen el oxígeno disuelto en agua, o el dióxido de azufre disuelto en agua.
- Líquido en líquido. También es una disolución muy utilizada. Al combinar distintas mezclas de alcohol en agua se obtiene este tipo de disolución. En este caso se cambia la densidad final.
Disoluciones gaseosas
- Gas en gas. Es el tipo de disolución más común. El ejemplo más evidente es el aire, que esta compuesto por oxígeno y otros gases disueltos en nitrógeno. Debido a que es un tipo de disolución donde prácticamente no hay interacción molecular, a menudo no se clasifican como soluciones, sino como mezclas.
- Sólido en gas. No es el tipo de disolución más común que existe, sin embargo, una de las más comunes es la que se produce con el yodo sublimado que se disuelve en nitrógeno. Otro ejemplo es el polvo atmosférico que se disuelve con el aire.
- Líquido en gas. En este caso el ejemplo más común es el aire húmedo.
Ejemplos de disoluciones
Ahora veamos algunos de los ejemplos de disoluciones más comunes
- Agregar azúcar al agua es un ejemplo muy común de disolución. En este caso, el azúcar actúa como el soluto, mientras que el agua es el solvente.
- Otro ejemplo de disolución es la mezcla de sal y agua. Es decir, la disolución de un compuesto iónico. Lo que sucede es que el cloruro de sodio, sal se disocia en iones de sodio y cloruro al momento de mezclarse con agua.
- Finalmente, liberar el helio de un globo a la atmósfera también es un ejemplo de disoluciones. Esto ocurre porque el gas helio se disuelve en el mayor volumen de aire.
¿Cuál es la función del soluto en las disoluciones?
En las disoluciones, el soluto es la sustancia que se disuelve en una solución. Cuando se trata de soluciones de fluidos, el solvente está presente en mayor cantidad que el soluto. También se debe tener en cuenta la concentración, la cual es una medida de la cantidad de soluto presente en una solución química, con relación a la cantidad de solvente.
Diferentes tipos de solutos
Cuando se mezclan dos líquidos para formar una solución, el soluto es la sustancia que se encuentra presente en menor proporción. Por ejemplo, en una solución de ácido sulfúrico 1M, el ácido sulfúrico es el soluto mientras que el agua es el solvente.
Cabe mencionar que los términos “soluto” y “disolvente”, se pueden aplicar a aleaciones y soluciones sólidas. Por lo tanto, el carbono puede considerarse un soluto en el acero.
Ejemplos de solutos
Generalmente un soluto es un sólido que se disuelve en un líquido. El ejemplo más común de soluto es la sal en el agua . La sal es el soluto que se mezcla en agua, el solvente, para formar una solución salina.
Además, el vapor de agua también se considera un soluto en el aire, debido a que el nitrógeno y el oxígeno están presentes en niveles de concentración mucho mayores en el gas.
Solubilidad
La solubilidad es básicamente, la cantidad máxima de una sustancia que se puede disolver en otra. En otras palabras, es la cantidad máxima de soluto que se puede disolver en un solvente, produciendo con ello una solución saturada.

No obstante, cuando se cumplen ciertas condiciones, es posible disolver soluto adicional más allá del punto de solubilidad de equilibrio. Con ello se obtiene una solución sobresaturada. Más allá de una solución saturada o sobresaturada, agregar más soluto no incrementa la concentración de la solución. Por el contrario, el exceso de soluto comienza a precipitarse fuera de la solución.
También es importante aclarar que la solubilidad no es la misma propiedad de la materia que la velocidad de la solución, la cual describe la rapidez con que un soluto se disuelve en un disolvente. Tampoco es lo mismo que la capacidad de una sustancia para disolver otra como resultado de una reacción química.
Por ejemplo, el zinc metálico se puede disolver en ácido clorhídrico mediante una reacción de desplazamiento que da como resultado iones de zinc en solución y la liberación de gas hidrógeno. En este caso los iones de zinc son solubles en ácido, por lo que la reacción no es una cuestión de solubilidad del zinc.
En casos similares, un soluto es un sólido, como el azúcar, o la sal, mientras que un solvente es un líquido como el agua, o el cloroformo. Sin embargo, el soluto o solvente puede ser un gas, líquido o sólido. Por su parte, el disolvente puede ser una sustancia pura o una mezcla.
Miscibilidad y solubilidad
Cuando una sustancia es soluble en todas las proporciones en un disolvente específico, se dice que es miscible en dicho disolvente, o que posee la propiedad denominada miscibilidad. Por ejemplo, el etanol y el agua son totalmente miscibles entre sí. Por el contrario, el aceite y el agua no se mezclan ni se pueden disolver entre sí. En consecuencia, el aceite y el agua se consideran inmiscibles.
¿Qué implica la solubilidad?
La manera en que se disuelve un soluto depende de los tipos de enlaces químicos, tanto en el soluto y el solvente. Es decir, cuando el etanol se disuelve en agua, mantiene su identidad molecular como etanol. A pesar de ello, se forman nuevos enlaces de hidrógeno entre las moléculas de etanol y agua.
Por esta razón, cuando se mezcla etanol y agua se produce una solución con un volumen menor que el que obtendría al sumar los volúmenes iniciales de etanol y agua. Si se disuelve cloruro de sodio u otro compuesto iónico, el compuesto se disocia en sus iones. Como resultado, los iones se rodean por una capa de moléculas de agua.
Por lo tanto, la solubilidad implica un equilibrio dinámico, en el que están involucrados procesos opuestos de precipitación y disolución. El equilibrio se alcanza cuando dichos procesos ocurren de manera constante.
Unidades de solubilidad
Los gráficos y tablas de solubilidad muestran la solubilidad de varios compuestos, solventes, temperatura y otras condiciones. En este sentido, la Unión Internacional de Química Pura y Aplicada (IUPAC) define la solubilidad en términos de una proporción de soluto a disolvente.
Las unidades de concentración que se utilizan en la solubilidad incluyen la molaridad, molalidad, la masa por volumen, la relación molar, y la fracción molar, entre otras.
¿Qué factores afectan la solubilidad?
La solubilidad puede verse afectada por la presencia de otras sustancias químicas en una solución. También por las fases del soluto y el solvente, la temperatura y la presión, así como el tamaño de las partículas del soluto y la polaridad.
Video sobre disoluciones:
Fuentes:
Thought.Co – Solubility Deninition in Chemestry
https://www.thoughtco.com/definition-of-solubility-604649
Thought.Co – Dissolve Definition in Chemestry
https://www.thoughtco.com/definition-of-dissolve-604432
Toppr – What is a Solvent?
Wikipedia – Disoluciones